
L'importanza di proteggere il tuo processo di verifica della sterilità
Durante l'intero processo produttivo, campioni di prodotto vengono prelevati e analizzati per verificare la contaminazione microbica. Nella maggior parte dei casi il test di sterilità dimostrerà che il prodotto è privo di contaminazione, consentendone la spedizione. Quando i risultati indicano che il prodotto è contaminato, la consegna viene interrotta per evitare di esporre i pazienti a potenziali rischi.
Se il processo di sterilizzazione non è adeguatamente protetto, la contaminazione ambientale può influire sul test e indicare che il prodotto è contaminato quando non lo è. Ciò può comportare costi significativi per il produttore e, potenzialmente, carenze di farmaci per i pazienti se il lotto deve essere scartato. Contribuisci a proteggere il processo di verifica della sterilità dalla contaminazione dell'ambiente circostante per ridurre il rischio di falsi positivi.
Che la metodologia utilizzata sia la filtrazione a membrana o l'inoculazione diretta, un isolatore può offrire notevoli vantaggi.

Scopri il nostro isolatore per verifica della sterilità
Bioquell Qube di Ecolab offre un ambiente asettico ISO 5 / Grado A e include la tecnologia integrata del vapore di perossido di idrogeno Bioquell*, ottenendo un'azione sporicida convalidata di 6 log sulle superfici esposte nelle aree operative. Dallo stampaggio in polimero all'integrazione con la pompa di sterilizzazione Merck Millipore Symbio Flex, Bioquell Qube è davvero unico e rappresenta la soluzione ideale per le verifiche di sterilità.
*Se utilizzati secondo le istruzioni sull'etichetta, i sistemi Ecolab Bioquell utilizzano lo sterilizzante al perossido di idrogeno Bioquell AQ (numero di registrazione EPA: 1677-277)
Un isolatore è la scelta giusta per te? Hai l'isolatore giusto?
Cosa significherebbe per te un falso positivo o un problema?
L'interruzione della produzione a causa di un falso positivo potrebbe comportare tempi di inattività significativi, scarti non necessari del prodotto, carenze di farmaci e potenzialmente compromettere la posizione di un'azienda sul mercato. Oltre a ciò, bisognerebbe tenere conto del tempo, della manodopera e dei costi aggiuntivi derivanti dalle fasi correlate alle azioni correttive e preventive (CAPA).
Quanto spazio in camera bianca richiede il processo?
In genere, lo spazio della camera bianca deve essere ottimizzato, poiché i prezzi per piede quadrato per la costruzione e la gestione dello spazio possono essere piuttosto elevati. Un isolatore come Bioquell Qube ha un ingombro ridotto e può essere spostato facilmente in base alle esigenze, non richiede lavori di costruzione e può essere utilizzato in aree di grado inferiore. Per le specifiche, contatta Ecolab.
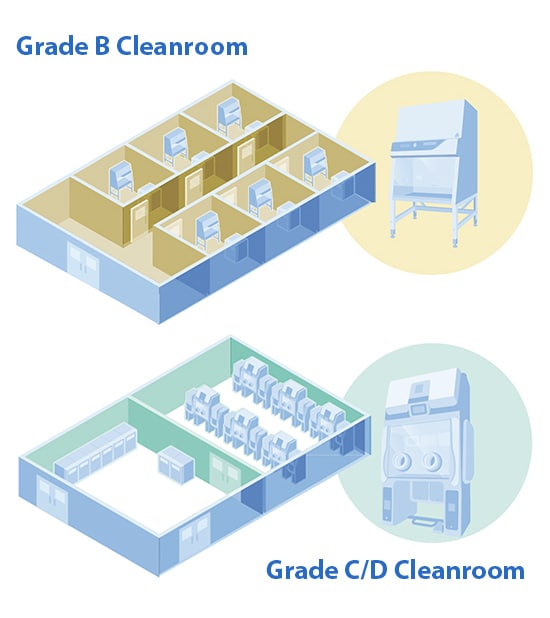
Il tuo processo di verifica della sterilità richiede una camera bianca di Grado B?
Grazie agli isolatori, è possibile eseguire verifiche in camere bianche di grado inferiore, che richiedono meno indumenti specifici o nessuno. Inoltre, è possibile conservare spazio prezioso nella camera bianca per altre operazioni critiche e contribuire a ridurre i costi operativi, poiché le camere bianche di grado superiore richiedono maggiori investimenti finanziari in termini di costi energetici e di manutenzione.
Il tuo processo attuale è convalidato e realmente ripetibile?
La biodecontaminazione automatizzata dei materiali in entrata è un processo convalidato, che garantisce la stessa efficacia a ogni ciclo. Ciò contribuisce ulteriormente a ridurre il rischio di falsi positivi.
Quanti test di sterilità bisogna eseguire in un giorno?
In genere, lo spazio della camera bianca deve essere ottimizzato, poiché i prezzi per piede quadrato per la costruzione e la gestione dello spazio possono essere piuttosto elevati. Un isolatore come Bioquell Qube ha un ingombro ridotto e può essere spostato facilmente in base alle esigenze, non richiede lavori di costruzione e può essere utilizzato in aree di grado inferiore. Ad esempio, Bioquell Qube può gestire fino a 60 test al giorno, a seconda della configurazione. Per le specifiche, contatta Ecolab.
Stai esternalizzando il processo di verifica della sterilità?
Ci sono dei vantaggi nello svolgere il processo internamente, tra cui un maggiore controllo sul processo, risparmi sui costi a lungo termine e risultati più rapidi. La scelta di un isolatore che può essere ospitato in aree CNC o camere bianche di grado inferiore consente alle aziende di realizzare questo obiettivo, nonostante i costi iniziali legati alle apparecchiature.

L'impatto del fallimento
L'impatto di un fallimento di una verifica può essere significativo per un produttore farmaceutico, in quanto in genere comporta:
- Sospensione del rilascio del prodotto e potenziale dismissione del lotto di prodotto che non ha superato la verifica
- Ulteriore pulizia e disinfezione delle aree di produzione
- Coinvolgimento di enti normativi
- Perdite finanziarie per la produzione
- Esecuzione di indagini tempestive
- Carenze di farmaci per i pazienti
- Interruzione della produzione di ulteriore prodotto durante l'esecuzione delle indagini
Tuttavia, i fallimenti delle verifiche di sterilità non sono sempre causati dalla contaminazione del prodotto.
Un falso positivo può verificarsi quando la contaminazione proveniente dall'ambiente o dall'operatore che esegue il test penetra nel test, causandone il fallimento. Un prodotto sarà considerato contaminato anche se in realtà è privo di microrganismi nocivi.
In caso di fallimento della verifica di sterilità, l'onere della prova spetta al produttore, che deve dimostrare che il fallimento è dovuto a una contaminazione da parte dell'operatore e/o dell'ambiente di laboratorio, un compito difficile da dimostrare. Di conseguenza, i falsi positivi spesso portano allo scarto non necessario di prodotti conformi ed efficaci.
Proteggi la tua attività con un isolatore per le verifiche di sterilità

Linee guida normative sugli isolatori:
- L'Allegato GMP UE 1 sezione 10.6 afferma:
"Il test di sterilità deve essere eseguito in condizioni asettiche"
- Le linee guida della FDA per l'industria per i prodotti farmaceutici sterili fabbricati mediante trattamento asettico compiono un ulteriore passo avanti e affermano nella sezione XI:
"L'uso di isolatori per i test di sterilità riduce al minimo la possibilità di un risultato falso positivo della verifica"
- Secondo l'Allegato GMP UE 1, un isolatore è:
"Una cabina in grado di essere sottoposta a biodecontaminazione interna riproducibile, con una zona di lavoro interna che soddisfa le condizioni di Grado A e che fornisce un isolamento continuo e senza compromessi del suo interno dall'ambiente esterno"

Gli isolatori presentano una serie di caratteristiche per proteggerei processi asettici, tra cui:
- Guarnizioni ermetiche / gonfiabili su tutte le porte
- Interblocchi per impedire l'apertura delle porte una volta raggiunte le condizioni asettiche (dopo la biodecontaminazione)
- Flusso d'aria unidirezionale tra 0,36-0,45 m/s (per conformarsi ai valori guida dell'allegato GMP dell'UE 1)
- Filtri HEPA per la pulizia dell'aria in ingresso
- Differenziali di pressione, prova di pressione della cabina e dei guanti separatamente
- Sistemi di monitoraggio ambientale per assicurarsi che l'ambiente rimanga asettico durante l'uso
- Allarmi di flusso d'aria e di pressione
- Sistema di biodecontaminazione a vapore di perossido di idrogeno che raggiunge un abbattimento sporicida pari a 6 log*, per eliminare la contaminazione sulle superfici delle cabine e sui materiali in ingresso necessari per il processo di verifica
*Se utilizzati secondo le istruzioni sull'etichetta, i sistemi Ecolab Bioquell utilizzano lo sterilizzante al perossido di idrogeno Bioquell AQ (numero di registrazione EPA: 1677-277)
I vantaggi degli isolatori
In primo luogo, gli isolatori riducono il rischio di falsi positivi durante le verifiche di sterilità, il che può far risparmiare milioni di dollari ai fabbricanti di prodotti sterili, riducendo al minimo l'inutile scarto dei prodotti.
Come vantaggio secondario, gli isolatori possono anche consentire un risparmio sostanziale sui costi operativi.
A differenza di una cabina di sicurezza biologica (BSC) / cappa a flusso laminare (LAF), che deve essere situata in una camera bianca di Grado B, gli isolatori possono essere situati in una camera bianca di Grado C/D. In questo modo si possono ottenere risparmi sostanziali derivanti da:
- Bollette energetiche da sistemi HVAC di capacità inferiore
- Riduzione delle risorse di manodopera (per la pulizia e la disinfezione)
- Minore manutenzione della camera bianca
- Riduzione dei costi dei materiali di consumo per la pulizia e la disinfezione
- Riduzione degli indumenti necessari
- Maggiore efficienza degli operatori, che grazie alla riduzione degli indumenti necessari possono lavorare per periodi più lunghi
1Costo di una camera bianca per piede quadrato, Cleanroom Technology, 28 febbraio 2018

Confronto tra gli isolatori tradizionali in acciaio inossidabile e Bioquell Qube



