Standard impeccabili: padroneggiare il controllo della contaminazione nei prodotti per la cura della persona e nei cosmetici
Basato su un articolo originariamente pubblicato nel numero di giugno 2025 di Personal Care Magazine.

Stabilisci una procedura chiara e ripetibile per assicurarti di superare accuratamente la valutazione della pulizia visiva tra i diversi operatori.
Immagina che un singolo errore nella tua procedura di pulizia abbia offuscato la reputazione del tuo marchio nel giro di pochi giorni. Da quello che sembrava essere un semplice passo falso nella tua procedura di pulizia e sanificazione (C&S), ora ti trovi di fronte a un richiamo di prodotto e a un comunicato stampa per avvertire i consumatori, un'analisi formale delle cause profonde e un piano d'azione correttivo, oltre a molte altre responsabilità. I costi finanziari e di reputazione sono sconcertanti, con potenziali indagini della FDA che si aggiungono al carico già gravoso. Hai dedicato ore, giorni o addirittura settimane per correggere un problema che avrebbe potuto essere facilmente evitato con adeguati controlli C&S. Nel mondo della cosmesi, garantire apparecchiature impeccabili non è solo una questione di conformità, ma anche di salvaguardare la fiducia e la salute dei consumatori.
La maggior parte delle normative a livello globale richiede che i prodotti per la cura della persona e i cosmetici non subiscano alterazioni o contaminazioni. Il produttore deve rispettare queste normative controllando le fasi critiche del processo per assicurarsi che non si verifichi alcuna contaminazione. È possibile implementare diversi controlli nei processi di produzione e confezionamento, nei processi di pulizia, nell'igiene dei dipendenti e dell'impianto, nei controlli sulle materie prime e nel training dei collaboratori, solo per citarne alcuni. La pubblicazione della bozza delle attuali buone prassi di produzione (cGMP) del Modernization of Cosmetics Regulation Act (MoCRA) è ancora in sospeso, e con essa arrivano le speculazioni su ciò che sarà o non sarà richiesto. Lo standard internazionale delle GMP per i cosmetici, ISO 22716:2007, può essere citato come indicazione di potenziali linee guida che potrebbero influenzare la bozza delle GMP MoCRA. Ad esempio, le norme ISO 22716:2007 - 4.10.3 e 4.10.4 richiedono la verifica dell'efficacia di agenti detergenti e/o igienizzanti specifici nonché la loro selezione e applicazione in base alle esigenze specifiche di ogni area della struttura. In altre parole, varie aree della struttura possono richiedere SOP di pulizia diverse e l'efficacia di ogni SOP deve essere verificata. Per fare un altro esempio, la norma ISO 22716:2007 - 7.2 sottolinea, tra gli altri requisiti, l'importanza della documentazione, della tracciabilità, dei controlli di qualità e della gestione dei lotti. Questo delinea la pressione del settore a muoversi verso le ideologie "First Time Right" (FTR), assicurandosi che le operazioni siano pronte per l'audit e che i prodotti siano fabbricati e consegnati secondo le specifiche.
In definitiva, queste linee guida cGMP aiutano a mitigare il rischio di contaminazione e forniscono alle aziende la certezza di immettere sul mercato prodotti sicuri e di qualità. Bisogna riconoscere che qualsiasi nuova GMP può essere incutere timore in una prima fase. Considerando che la C&S è una componente chiave delle GMP, questo articolo illustrerà, in termini generali, i rischi e le migliori pratiche associati ai processi di pulizia per le apparecchiature di lavorazione critiche.
Il costo delle apparecchiature sporche
Nel mondo digitalmente connesso in cui viviamo, nel giro di pochi giorni, il marchio di un'azienda può subire un impatto negativo tramite i social media, quando i "difetti" del prodotto arrivano nelle mani del consumatore. Allo stesso modo, le segnalazioni dei risultati di un audit normativo o di un richiamo possono danneggiare l'immagine del marchio. Le cause di questi difetti o dei risultati di questi audit possono essere molteplici, tra cui residui trasmessi dalla produzione precedente a causa di una pulizia o sapori inadeguati e cambiamenti di viscosità dovuti a contaminazione microbiologica. In definitiva, i produttori puliscono per ridurre il rischio di contaminazione dei prodotti. I tipi di contaminazione includono la contaminazione crociata dei prodotti, la contaminazione crociata dei principi attivi, la contaminazione microbica o anche la contaminazione derivante dai prodotti per la pulizia. Alla luce di questi rischi, è fondamentale comprendere gli standard di pulizia necessari per garantire la sicurezza e la qualità dei prodotti. Questo ci porta alla domanda: "Cosa s'intende per pulito?"
Cosa s'intende per pulito?
Il livello di pulizia necessario per evitare la contaminazione sembra un elemento soggettivo e aperto all'interpretazione. Ai fini della discussione, considera che i livelli di pulizia potrebbero essere valutati in base a tre livelli: pulizia visiva, pulizia residuale o pulizia microbica. Sebbene queste categorie di pulizia siano legate tra loro, ognuna è connessa a diversi livelli di rischio per il consumatore. Gli enti normativi incaricati di garantire la sicurezza del consumatore hanno fornito delle linee guida. Le sezioni seguenti esploreranno ogni livello, i rischi associati e le possibili soluzioni.
1. Pulizia visiva
L'ISO fornisce al settore uno standard di pulizia che parla di "pulizia visiva" nella norma ISO 22716 - 2007: Linee guida per le buone pratiche di fabbricazione (GMP) dei cosmetici2, dove la pulizia è descritta come "la separazione e l'eliminazione dello sporco generalmente visibile da una superficie" (sezione 2.8). Questa norma stabilisce che tutto lo sporco visibile debba essere rimosso dalla superficie dell'apparecchiatura.
Di tutti i tipi di contaminazione, questo standard sembra il più semplice da ottenere e confermare. Tuttavia, nella pratica, le cose non vanno sempre così. Definire lo "stato di base" o il punto di partenza può presentare delle ambiguità. Per esempio, cosa accade se il serbatoio è macchiato, colpito da rouge o danneggiato, tanto che nessuno si ricorda più della bellissima patina argentata del nuovo acciaio inossidabile? Come si stabilisce uno standard di pulizia visiva? In una situazione come questa, si potrebbe effettuare un risanamento o una passivazione del serbatoio per riportare l'apparecchiatura allo "stato di base" o per farla tornare come nuova. In alternativa, attraverso la verifica (dei residui e microbica) e la valutazione del rischio, un gruppo qualità e un gruppo produzione potrebbero accordarsi sullo stato attuale più opportuni e su una nuova base di partenza.
Quindi, come si misura la pulizia visiva? La pulizia visiva è un metodo di verifica che richiede una procedura, una standardizzazione e forse una calibrazione. Esaminiamo tre variabili chiave che aiutano a definire ciò che è considerato visivamente pulito: condizioni di luce, condizioni della superficie e strumento di misurazione.
L'illuminazione o la sua assenza possono influire sulla capacità di vedere chiaramente la superficie. Pertanto, una procedura di ispezione C&S deve includere una definizione di illuminazione che specifichi la fonte luminosa, il tipo di lampadina, l'angolo di illuminazione e così via. Potrebbe essere necessaria anche la manutenzione di tale fonte luminosa, poiché le condizioni della lampadina potrebbero deteriorarsi nel tempo. A volte, potrebbe essere necessario un piano di manutenzione preventiva della fonte luminosa.
Anche le condizioni della superficie ispezionata sono essenziali. Ad esempio, una superficie bagnata può sembrare diversa da una asciutta e mascherare la presenza di residui di sporco. Per questo motivo, la procedura deve specificare le condizioni delle superfici, cioè se devono essere bagnate o asciutte per l'ispezione.
L'operatore è lo "strumento" o il dispositivo di verifica principale in una valutazione di pulizia visiva. L'operatore deve essere qualificato o ritenuto in grado di effettuare il test. L'acuità visiva, le lenti correttive e la capacità di distinguere i colori possono essere fondamentali per qualificare un tecnico ai fini di una valutazione della pulizia visiva. Una volta stabilita la capacità, il tecnico dovrebbe essere istruito sulle corrette tecniche di ispezione seguendo la procedura scritta.
Una volta stabiliti tali requisiti procedurali, bisogna delineare i criteri in base ai quali la verifica può considerarsi superata. Poiché nessun risultato numerico di un test è legato a una valutazione visiva, è necessario uno standard visivo che garantisca una misurazione coerente rispetto ai criteri di superamento. Ciò si ottiene spesso attraverso uno standard visivo creato con foto di situazioni visive accettabili e non accettabili. I risultati andrebbero documentati a seguito di ogni pulizia. Questi standard visivi aiutano a mitigare il rischio associato alla presenza di più operatori qualificati per condurre il test visivo. Sebbene i formati cartacei e digitali siano accettabili per implementare queste procedure, ci sono molti vantaggi nell'utilizzare un formato digitale. Questi includono, a titolo esemplificativo ma non esaustivo, un'esperienza di formazione più interattiva e coinvolgente per gli operatori e una solida documentazione e tracciabilità dei dati storici per la preparazione all'audit.
2. Pulizia residuale
Anche se le apparecchiature possono risultare pulite a un livello di "pulizia visiva", i residui presenti a livelli non visibili possono avere un impatto sulla sicurezza dei consumatori. Ad esempio, alcuni principi attivi, come gli ingredienti chimici delle creme solari, non sono rilevabili visivamente. Inoltre, i detergenti possono lasciare dei residui che influiscono sulla qualità del prodotto se non risciacquati a sufficienza, e che potrebbero non essere rilevabili tramite un'ispezione visiva.
La rimozione di tutti i livelli rilevabili di prodotto, principi attivi e detergenti per garantire una superficie pulita non è un processo economico per i produttori, in quanto potrebbe comportare quantità eccessive di tempo e acqua. A seconda del settore, le agenzie di regolamentazione possono adottare un approccio basato sul rischio, richiedendo che i residui vengano ridotti a un "livello sicuro" per l'uso da parte dei clienti. Spesso, questo "livello sicuro" si basa su una valutazione tossicologica, per garantire che la quantità residua trasferita al lotto successivo sia ben al di sotto di un effetto osservabile o di un livello che porti a eventi avversi. Ciò richiede che i produttori conoscano i residui che potrebbero essere presenti, un livello di residui sicuro e accettabile, un metodo per verificare il livello di residui e un processo di pulizia che rimuova in modo affidabile il prodotto, i principi attivi e il detergente per raggiungere tale livello di sicurezza. Un produttore cosmetico conosce la propria formulazione, quindi conosce i principi attivi o gli ingredienti della formulazione che potrebbero rimanere come residui e l'attività o la tossicità associate. In genere, avrà già sviluppato un metodo di verifica per il principio attivo, poiché è probabile che verifichi la formulazione finale per assicurarsi che rientri nelle specifiche. Potrebbe essere necessario verificare o modificare tale metodo di prova per misurare accuratamente i principi attivi residui inferiori dopo la pulizia. Spesso, un test non specifico come il Total Organic Carbon (TOC) può verificare l'effettiva rimozione degli ingredienti non attivi di una formulazione.
L'incognita più grande per i produttori di cosmetici potrebbe risiedere nel detergente per la pulizia. Un fornitore affidabile è in grado di condividere le informazioni sulla tossicità del detergente e metodi di verifica adeguati per determinarne i residui. All'interno dell'industria, i metodi di prova possono essere specifici (ovvero identificano il particolare componente chimico) o non specifici (ovvero indicano la presenza di un residuo ma non la sostanza chimica specifica) sulla base di una valutazione del rischio di tossicità. Spesso, i detergenti utilizzati nelle applicazioni cosmetiche sono a basso rischio e possono essere testati con metodi non specifici. Ne sono degli esempi il Total Organic Carbon (TOC), la conducibilità, il pH, ecc. In ognuno di questi casi, è necessario un lavoro di laboratorio per fornire una correlazione o una traduzione dal risultato del metodo non specifico al livello effettivo di residui. Il produttore dei detergenti dovrebbe essere in grado di prestare assistenza in questo processo.
Se da un lato ottenere una pulizia residua è fondamentale per eliminare i contaminanti nascosti, dall'altro è altrettanto importante affrontare le minacce microbiche che possono compromettere la sicurezza dei prodotti. Questo ci porta all'ultimo livello di pulizia: garantire che le apparecchiature siano pulite dal punto di vista microbico.
3. Pulizia microbica
La contaminazione microbica causata dalla carica microbica nelle apparecchiature sta diventando un problema sempre più significativo e attrae sempre più interesse nell'industria cosmetica. Prima di esplorare le opzioni per controllare la contaminazione microbica è necessario chiarire i termini. Sono due i termini che confondono l'ambito globale: sanificazione e disinfezione. Negli standard EPA e USP , la riduzione della carica microbica è indicata come sanificazione, mentre la disinfezione è definita come la distruzione o l'inattivazione irreversibile dei microrganismi. In questo articolo, utilizzeremo il termine sanificazione per indicare la riduzione della carica microbica ai livelli desiderati, indipendentemente dalla posizione geografica dell'applicazione.
Una volta raggiunti i livelli di residui e di pulizia visiva, c'è ancora la possibilità che sulle apparecchiature siano presenti dei residui microbici che possono contaminare un prodotto cosmetico. In casi di contaminazione microbica estrema, come in zone viscide e scolorite che indicano la presenza di biofilm, il problema può essere rilevato con un'ispezione visiva. Spesso, la contaminazione microbica viene rilevata solo attraverso la verifica del prodotto finito, con elevate conte microbiche che portano a scartare i lotti. Sebbene storicamente non si siano verificati problemi di contaminazione microbica per i prodotti fabbricati in un impianto, le attuali tendenze si spostano verso ingredienti più naturali, che potrebbero aumentare la possibilità di introdurre flora microbica mai vista prima. Inoltre, l'opzione dei conservanti si riduce sempre di più, man mano che l'UE elimina i conservanti dagli elenchi autorizzati per l'uso nell'industria cosmetica, riducendo la garanzia che la formulazione possa contrastare la crescita microbica e la contaminazione.

Senza adeguate procedure di pulizia e sanificazione, le tue apparecchiature sono a rischio di crescita microbica, che potrebbe presentarsi sotto forma di biofilm al loro interno
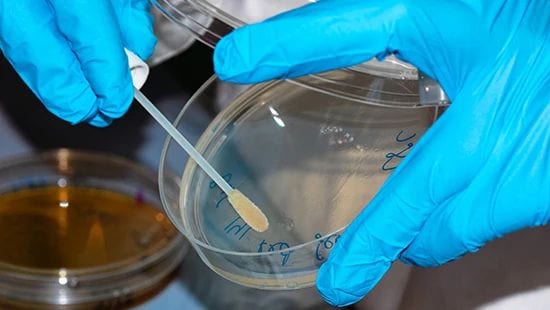
Il micro tampone è un metodo comune per testare i residui microbici.
I residui microbici possono essere misurati con micro tamponi o con campioni di acqua di risciacquo, a seconda del design e delle condizioni delle apparecchiature. I problemi legati alla verifica dei residui microbici sono unici e sono soprattutto connessi all'accesso ai punti di campionamento. Spesso, le aree delle apparecchiature a più alto rischio di crescita microbica sono aree non facilmente accessibili, come tubi, giunti di apparecchiature o, in alcuni casi, superfici di apparecchiature danneggiate da usura o corrosione. Queste zone difficili da raggiungere per il campionamento sono anche quelle più difficili da sanificare efficacemente, creando un fattore di rischio.
Il metodo principale per controllare il residuo microbico sulle apparecchiature pulite è con una fase di sanificazione. I fabbricanti di prodotti per la cura della persona e cosmetici utilizzano storicamente la disinfezione termica per ridurre i residui microbici. Le tendenze nella formulazione summenzionate accrescono sempre più l'importanza di mantenere un buon controllo microbico nelle apparecchiature di produzione. Le ulteriori pressioni per controllare i costi e ridurre l'utilizzo energetico spingono le aziende a passare dalla sanificazione con acqua calda a quella chimica. La sicurezza che il processo termico sia efficace e funzioni in uno stato convalidato dipende fortemente dalla temperatura e dal tempo per tutti i punti di contatto delle apparecchiature. La sanificazione con prodotti chimici sta acquisendo popolarità grazie alla sua capacità di assicurare e convalidare l'efficacia microbiologica con un prodotto, una concentrazione e tempi di contatto specifici, spesso a temperatura ambiente e per pochi minuti.
In breve
Garantire che i prodotti per la cura personale e i cosmetici siano realizzati in un ambiente privo di contaminazione è essenziale per la salute e la sicurezza dei consumatori. Uno step cruciale che il produttore può intraprendere è sviluppare un programma di pulizia e sanificazione che rimuova efficacemente la contaminazione dalla produzione. Questi contaminanti possono essere residui di prodotti (attivi o meno), detergenti o carica microbica. Pulire fino a uno standard di "pulizia visiva" è imperativo ed è un punto di partenza non negoziabile. Lo sviluppo di uno standard (processi, limiti di accettazione e training) è fondamentale.
Abbiamo esaminato il fatto che ottenere una "pulizia visiva" potrebbe non essere sufficiente. I residui non visibili, come i residui attivi, i residui dei detergenti o la carica microbica, possono contribuire alla contaminazione e influire sulla qualità dei prodotti. I programmi di pulizia e sanificazione devono affrontare rigorosamente tutti questi tipi di residui per offrire la certezza che la qualità dei prodotti non venga compromessa.
Per assicurarti che i tuoi prodotti soddisfino i più elevati standard di pulizia e sicurezza, considera la possibilità di collaborare con esperti specializzati nel controllo della contaminazione. In questo modo puoi salvaguardare la reputazione del tuo marchio, proteggere la salute dei consumatori e stare al passo con i requisiti normativi. Non aspettare che si verifichi un problema di contaminazione: adotta ora delle misure proattive per implementare un solido programma di pulizia e sanificazione.

Superare le sfide nell'area di produzione
Ecolab può ottimizzare i tuoi processi di fabbricazione di prodotti per la cura della persona.
Risparmia notevolmente in termini di tempo e spese.
Fonti
- L'allegato 15 delle linee guida GMP dell'UE afferma che "i limiti di contaminazione residua del prodotto devono basarsi su una valutazione tossicologica. La giustificazione dei limiti selezionati deve essere documentata nel quadro di una valutazione dei rischi che includa tutti i riferimenti complementari."
- Fonte: https://www.epa.gov/pesticide-registration/pesticide-registration-manual-chapter-4-additional-considerations
- Fonte: USP Chapter 1072



